Как провериться на наследственные заболевания перед беременностью

К планированию беременности мы подошли с оглядкой на последние достижения медицины. Первым этапом стало тестирование на носительство мутаций моногенных заболеваний.
Каждый из нас может быть носителем нескольких патогенных мутаций, которые передаются из поколения в поколение и не вызывают болезни до тех пор, пока не произойдет встреча двух носителей мутации в одном и том же гене. Тогда вероятность появления патологии у их ребенка может достигать 50%.
Генетический тест перед планированием беременности позволяет с высокой долей вероятности убедиться, что ребенок родится без наследственных заболеваний, которые называют моногенными.
Расскажу о том, почему этот тест нужен всем, кто планирует беременность, как его сделать в любой точке России и как при этом можно сэкономить.
Сходите к врачу
Наши статьи написаны с любовью к доказательной медицине. Мы ссылаемся на авторитетные источники и ходим за комментариями к докторам с хорошей репутацией. Но помните: ответственность за ваше здоровье лежит на вас и на лечащем враче. Мы не выписываем рецептов, мы даем рекомендации. Полагаться на нашу точку зрения или нет — решать вам
Что такое моногенные заболевания
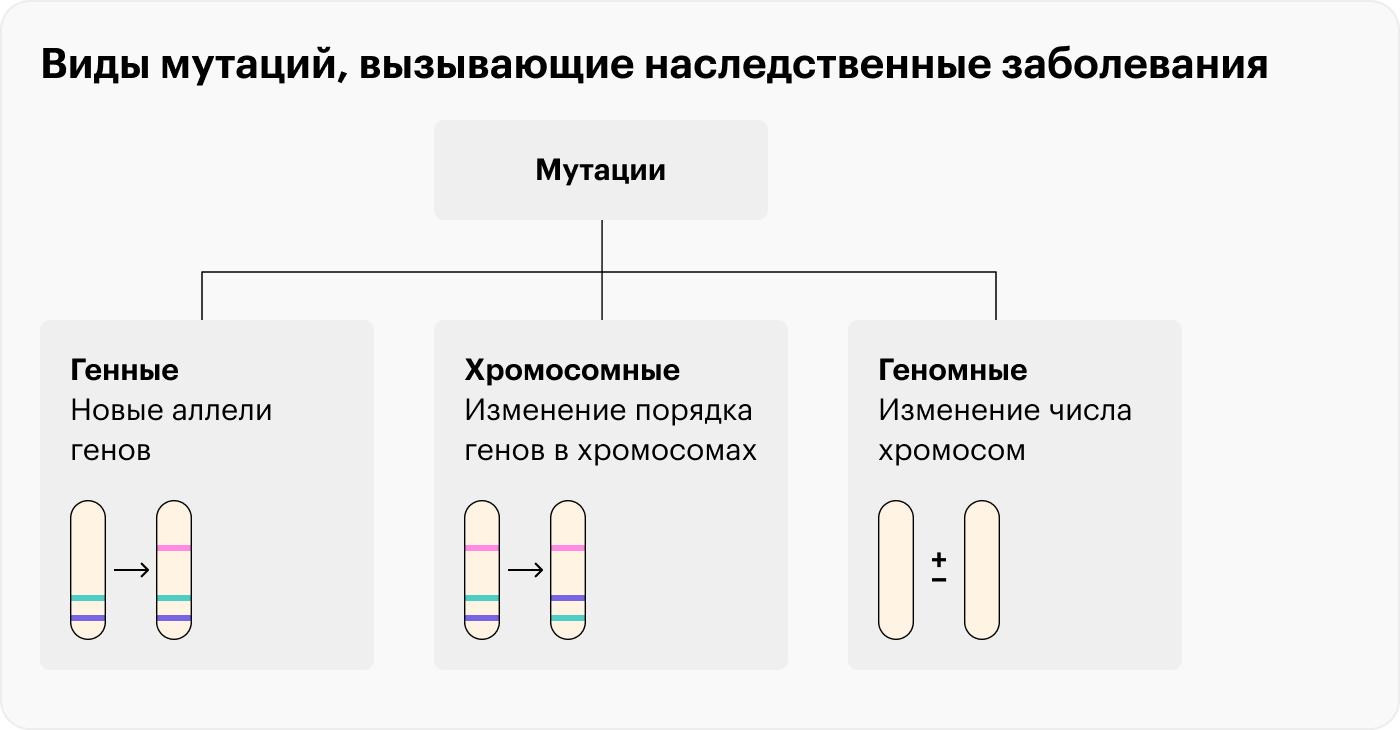
Моногенные болезни — это наследственные заболевания, вызванные изменением в одном гене. Например, к ним относятся спинальная мышечная атрофия, муковисцидоз, болезнь Тея — Сакса, болезнь Гоше.
Известно несколько тысяч моногенных болезней, но большинство из них очень редкие. Например, пикнодизостоз — скелетная дисплазия, из-за которой пациенты предрасположены к спонтанным переломам, диагностируется у одного-двух человек из миллиона. А вот одно из самых часто встречающихся моногенных заболеваний — муковисцидоз — среди европейцев случается у одного из 2500—4500 людей.
В последнее время в прессе много пишут о спинальной мышечной атрофии, СМА, для которой совсем недавно разработали сразу несколько вариантов эффективного, но очень дорогого лечения. СМА встречается с частотой один случай на 6000—10 000 новорожденных. Это прогрессирующее нервно-мышечное заболевание, поражающее двигательные нейроны спинного мозга. Симптомы болезни: слабость мышц ног, рук, шеи и органов, отвечающих за глотание и дыхание.
В отличие от некоторых других мышечных атрофий, симптомы СМА проявляются с третьего по шестой месяц жизни ребенка. Истории о людях со СМА пугают в первую очередь тем, что показывают: никто не застрахован от рождения ребенка с моногенным заболеванием.
Появление такой патологии у малыша, родители которого здоровы, кажется невероятным, ведь речь идет о наследственном заболевании. Но именно так и бывает. В случае со СМА причина — мутация в гене SMN1.
Как наследуются рецессивные гены
Вспомним школьный курс биологии. У человека есть две копии всех генов: одна достается нам от мамы, другая — от папы. Существуют доминантные гены, их обозначают «А», и рецессивные гены, «а». Доминантные гены подавляют рецессивные, поэтому если у человека есть оба эти гена, то проявляется только доминантный. В зависимости от того, какой ген вы получили от каждого из родителей, вы можете быть носителем следующих комбинаций: АА, Аа, аА, аа.
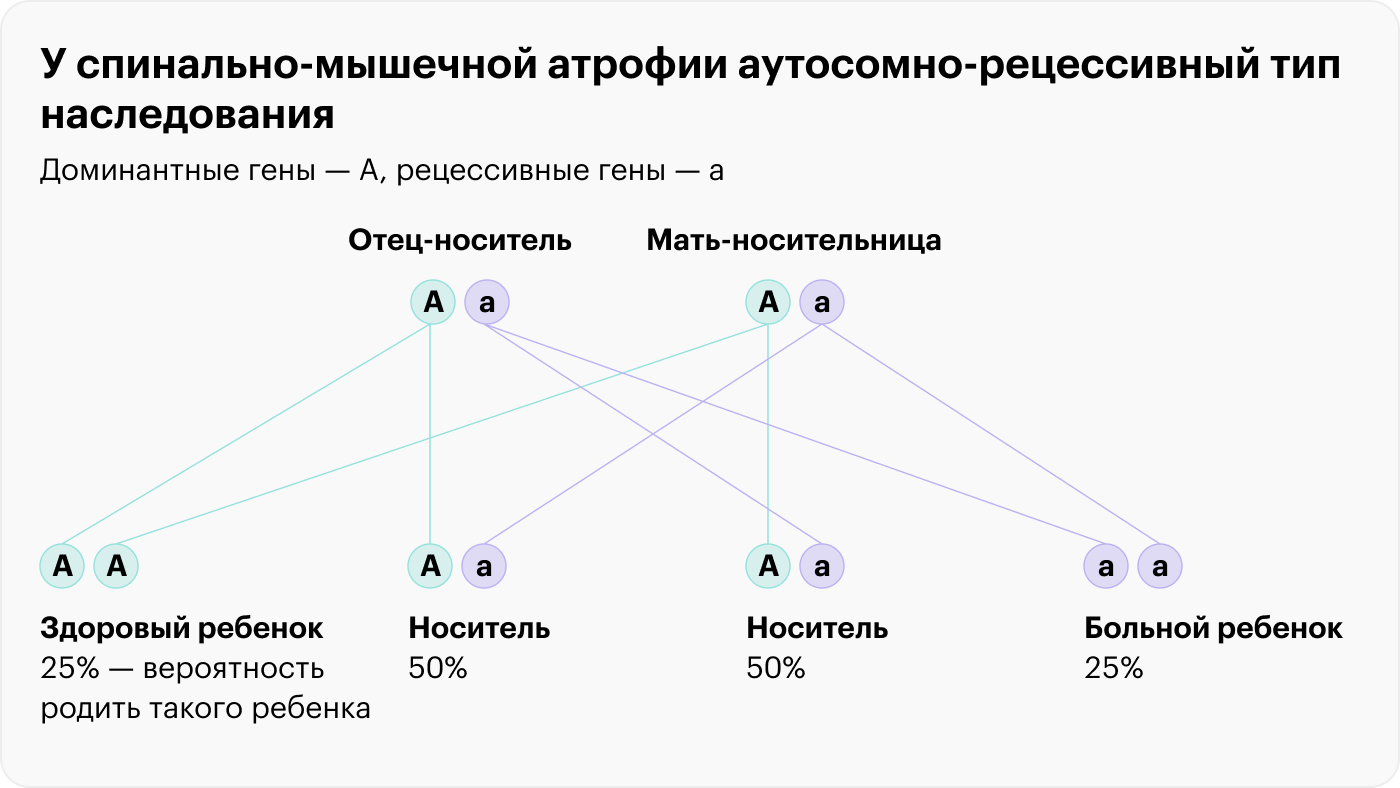
Разберемся на примере спинальной мышечной атрофии. Мутации в гене SMN1 — рецессивные, то есть мутантный ген обозначается маленькой буквой «а». Если даже оба родителя — носители гена SMN1 с мутацией, ребенок может унаследовать такой вариант только от одного из родителей, и тогда не произойдет ничего страшного.
Часто именно так и бывает: в трех из четырех случаев рецессивный ген идет в комбинации с доминантным, поэтому заболевание не проявляется. Но в одном из четырех случаев ребенок родится со СМА.
А теперь плохие новости: примерно каждый 40-й человек — носитель мутации в гене SMN1. А еще таких моногенных болезней, как спинальная мышечная атрофия или муковисцидоз, несколько тысяч. То есть вероятность, что оба будущих родителя — носители мутаций, способных привести к моногенному заболеванию, как минимум не ничтожная.
Какие бывают тесты на носительство мутаций моногенных болезней
Тесты на носительство мутаций предлагают практически все крупные сети медицинских лабораторий. Для тестирования они могут использовать любой биоматериал — волосяные луковицы, слюну, эпителий с внутренней стороны щеки. Однако почти все лаборатории предпочитают брать венозную кровь. Из нее выделяют ДНК и анализируют, определяя нуклеотидную последовательность с помощью метода секвенирования.
Мы с мужем выбрали исследование полного экзома методом секвенирования нового поколения NGS. Экзом — это смысловая часть генома: там есть информация о генах, отвечающая за синтез белка в организме. Технология позволяет исследовать сразу большое количество генов. Есть также методы исследования отдельных мутаций MLPA, ПЦР, иммуногистохимия — ИГХ, флуоресцентная гибридизация — FISH.
Выбрать можно любую панель тестирования в зависимости от вашего запроса. Возможно, вы знаете о моногенном заболевании у родственника, тогда вам важно протестироваться именно на него. Или вы готовы провериться на наличие максимального числа мутаций. И все же лучше всего перед тестированием проконсультироваться с врачом-генетиком, который подскажет, на что следует обратить внимание при выборе теста.
В целом панели отличаются по спектру исследуемых генов, цене и срокам проведения исследования. Цены на одни и те же тесты могут варьироваться в разных городах и лабораториях. Ниже я привожу цены, актуальные для Краснодара, где мы и проходили тестирование.
Часто лаборатории предлагают одновременное тестирование обоих партнеров. Но нет смысла переплачивать: тест может сделать один партнер, а второй после получения результатов исследует только те гены, в которых были обнаружены мутации. Для этого проводят секвенирование по Сэнгеру — этот анализ позволяет протестировать один или несколько генов.
Многие крупные генетические лаборатории имеют свои кабинеты или партнерство с местными лабораториями практически в любом городе России. Кровь у вас возьмут на месте, а на исследование отправят ее туда, где базируется выбранная вами лаборатория. За транспортировку биоматериала, скорее всего, придется немного доплатить.


Чем различаются панели и какую лучше выбрать
Можно выбрать минимальную панель, в которую входит исследование на носительство СМА и муковисцидоза. Результат будет готов быстро: сроки важны для тех, кто уже находится в процессе ЭКО. С муковисцидозом связаны 23 мутации в гене CFTR, они отвечают за 95—97% всех случаев этого заболевания среди европейцев. Скрининг считается хорошим, если покрывает 23 мутации. На это следует обратить внимание при выборе лаборатории.
К минимальной панели можно добавить исследования на носительство фенилкетонурии и несиндромальной тугоухости — по статистике, в ее гене мутации встречаются у каждого 25-го человека в статусе здорового носительства.
Среди расширенных панелей есть тесты, основанные на секвенировании нового поколения NGS, когда можно исследовать мутации во всех известных генах, связанных с наследственными заболеваниями. С помощью такого теста вы узнаете и о так называемых вторичных находках — носительстве мутаций, способных повышать риск рака. Например, мутации в генах BRCA-1 и BRCA-2, которые могут привести к раку груди, как это было у Анджелины Джоли.
Есть также исследования специально для женщин. Например, когда проверяют на носительство мышечной дистрофии Дюшенна — она передается от здоровой матери мальчикам. А также исследование количества повторов в гене FMR1, синдрома ломкой Х-хромосомы, который может приводить к аутизму и умственной отсталости у мальчиков, чьи мамы-носители тоже здоровы.
Чтобы определиться с выбором лаборатории, я предлагаю смотреть на узкоспециализированные центры, занимающиеся в основном генетикой. До сдачи любого теста можно проконсультироваться с врачом-генетиком, чтобы подобрать то исследование, что подойдет именно вашей паре. Получить консультацию можно онлайн.
Кому обязательно нужно делать тест
В некоторых странах действуют различные программы для генетического скрининга будущих родителей. Например, для евреев-ашкенази существует программа для выявления болезни Тея — Сакса, которая приводит к поражению центральной нервной системы у детей, они редко доживают до четырех лет. Мутация в гене евреев-ашкенази веками передавалась из поколения в поколение, но благодаря многолетней программе болезнь практически исчезла. В России за генетический тест придется заплатить самостоятельно.
Поскольку никто не застрахован от рождения ребенка с наследственным моногенным заболеванием, ни для кого не будет лишним сделать тест за несколько месяцев до планирования беременности. Но есть ситуации, когда риск рождения ребенка с наследственным заболеванием выше среднего. Поэтому генетики рекомендуют обязательно делать тест в таких случаях:
- Пара состоит в кровнородственном браке, когда у супругов есть общий предок в ближайших поколениях.
- У пары уже есть ребенок с наследственным заболеванием.
- Имеется «отягощенная родословная» — у родственников обнаруживались наследственные заболевания.
- Уже были выкидыши или аномалии развития плода.
Мы с мужем не относимся к группам риска, но приняли решение сделать генетическое исследование, чтобы быть спокойными.
Как мы сделали тесты и что они показали
Мы решили, что тестирование будет проходить муж. Анализ он сдавал в 2019 году в Краснодаре в лаборатории KDL, которая сотрудничает с генетической лабораторией «Геномед» — ее мы выбрали по большей части случайно. Нам понравилась панель, которую предлагала эта лаборатория: она включала исследование 2500 генов и широкого спектра наследственных заболеваний методом секвенирования экзома NGS. Заплатили за тест 35 000 ₽, сейчас этот же тест стоит дешевле — 30 000 ₽.
Процесс взятия анализа ничем не отличается от обычной сдачи венозной крови. В лаборатории порекомендовали за сутки исключить алкоголь, жирную пищу и прийти натощак. На самом деле на сайтах лабораторий указано, что никакой особенной подготовки не требуется. За дополнительные 600 ₽ биоматериал мужа доставили в «Геномед» в Москву.
Кровь муж сдал 23 февраля, а 5 мая на электронную почту мы получили результат, то есть прошло больше времени, чем было обещано на сайте. В 2022 году для большинства исследований лаборатории указывают сроки в диапазоне 18—30 дней.
У мужа обнаружили патогенный вариант гена TSEN54. Некоторые мутации в этом гене, если они будут у обоих родителей, могут приводить ко второму, четвертому и пятому типам болезни, которая называется понтоцеребеллярной гипоплазией. Это настолько редкое заболевание, что ученые пока даже не подсчитали, с какой частотой оно встречается, но известно, что заболевание приводит к серьезным последствиям для ребенка — уменьшению размеров черепа и головного мозга, расстройствам дыхания, судорогам и задержке развития.
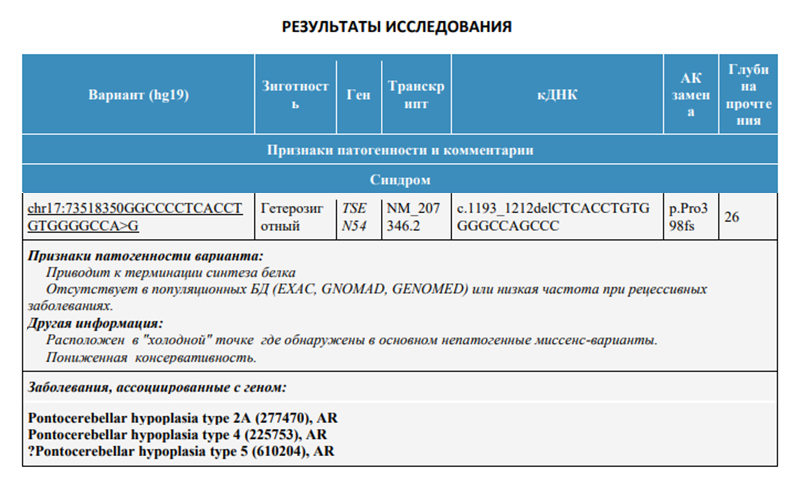
После полученного мужем результата я тоже сдала анализ на определение мутаций, но уже в этом конкретном гене TSEN54 методом секвенирования по Сэнгеру, который как раз позволяет проанализировать отдельный ген. Технически все происходило так же, как у мужа: я сдала кровь из вены в той же лаборатории. Сам анализ стоил 3800 ₽ плюс 600 ₽ за отправку биоматериала в Москву. Результат я получила через месяц: патогенные варианты в этом гене у меня не обнаружили.
В итоге генетическое тестирование обошлось нам ровно в 40 000 ₽.
- 40 000 ₽
- мы заплатили за генетическое тестирование
Уточню важный момент: мы консультировались со знакомыми генетиками в частном порядке до, во время и после тестирования. Чтобы не переплачивать за лишние анализы, посоветуйтесь с врачом — он подскажет, какой именно сделать тест. И не забывайте, что правильно интерпретировать результаты может только врач-генетик. Консультация генетика стоит в среднем 4000—6000 ₽. Лаборатории часто дают скидки на онлайн-консультацию для клиентов, сдавших тест.
Какие еще есть риски развития патологий и как их выявить
Благодаря тесту мы определили, что не относимся к носителям мутаций, приводящих к часто встречающимся моногенным заболеваниям. Но это не означает, что риски рождения ребенка с наследственным заболеванием нулевые.
Во-первых, существующие панели тестов не включают абсолютно все возможные варианты мутаций, способных стать причиной того или иного моногенного заболевания. Ученые регулярно обнаруживают все новые патологии.
Во-вторых, иногда причиной наследственной болезни становятся мутации de novo, то есть мутации, которых не было у родителей, но они возникли впервые у ребенка.
В-третьих, список наследственных заболеваний не ограничивается моногенными, есть также хромосомные, но для их диагностики нужны другие тесты. Например, синдром Дауна диагностируют методом кариотипирования.
К счастью, у нас родился здоровый ребенок, а моя беременность протекала в спокойствии, потому что я понимала: мы сделали все от нас зависящее, чтобы быть уверенными в здоровье малыша.
Если вы с партнером сделали тест и выяснилось, что вы оба носители мутации, приводящей к тому или иному моногенному заболеванию, вам предложат процедуру ЭКО с предимплантационным генетическим тестированием. Это тест, который позволяет до имплантации эмбриона в матку исследовать его на наличие хромосомных нарушений или мутаций.
Правда ли генетическое тестирование эмбриона сведет риски к нулю
Если подтверждено носительство патогенного варианта гена у обоих партнеров, то риск рождения больного ребенка слишком велик — от 20 до 50%. В этом случае ЭКО с предимплантационным генетическим тестированием, ПГТ, — единственный надежный способ родить ребенка, не больного моногенным заболеванием.
Тестирование полученных эмбрионов на пятом-шестом дне их развития позволяет отобрать для ЭКО те, что либо вовсе не имеют патогенного варианта гена, либо имеют патогенный ген в неактивной форме, как и их родители, но тогда в дальнейшем выросшему ребенку при планировании потомства потребуется обследование партнера.
Как и любая процедура, ПГТ несет в себе риск — хоть и менее 1,5% — повреждения эмбриона при заборе биопсии части клеток наружной оболочки, что может снизить его шанс на имплантацию, то есть прикрепление эмбриона в полости матки. Поэтому процедура проводится только эмбрионам высокого качества с большим количеством клеток в наружной оболочке.
В настоящее время супружеская пара, у которой выявлен высокий риск моногенного заболевания, может проходить процедуру ЭКО за счет ОМС.
Вот что покрывает программа:
- Овариальную стимуляцию — рост множества фолликулов.
- Пункцию фолликулов.
- Оплодотворение методом ИКСИ.
- Выращивание эмбрионов в инкубаторах.
- Подготовку эмбрионов к исследованию ПГТ.
- Криоконсервацию эмбрионов.
Перенос эмбриона в полость матки проводится уже отсроченно, после обнаружения пригодных для этого эмбрионов. На перенос тоже можно получить квоту за счет ОМС.
Непосредственно само исследование ПГТ пара оплачивает самостоятельно, стоит это примерно 30 000—35 000 ₽ за один тест.
Если вы прочитали эту статью, уже находясь в ожидании ребенка, не расстраивайтесь. Согласно приказу Минздрава № 572н, в период беременности всем женщинам в обязательном порядке назначают бесплатный трехразовый пренатальный скрининг, который позволяет оценить развитие малыша в динамике и выявить риски врожденных или генетических патологий.
Кроме того, можно пройти неинвазивное пренатальное тестирование, НИПТ, которое выявляет не моногенные заболевания, а хромосомные аномалии. НИПТ делают в первом триместре беременности — на 10—13-й неделе. Анализ стоит 16 000—70 000 ₽.
Существуют также расширенные панели НИПТ, включающие скрининг не только на хромосомные патологии, но и на некоторые наследственные моногенные болезни у плода.
Запомнить
- Сделать тест на носительство мутаций моногенных заболеваний нужно за несколько месяцев до начала планирования беременности.
- Тест обязателен для пар, входящих в группы риска.
- С выбором нужной панели поможет определиться врач. Если у вас нет особых показаний к тестированию, можно выбрать панель на свое усмотрение, но назначать и интерпретировать тест все равно должен врач-генетик.
- Если у обоих партнеров обнаружены мутации в одних и тех же генах, врачи могут предложить процедуру ЭКО с предварительным предимплантационным генетическим тестированием.
Новости о здоровье, интервью с врачами и инструкции для пациентов — в нашем телеграм-канале. Подписывайтесь, чтобы быть в курсе происходящего: @t_zdorov