13 важных вопросов генетику Ирине Жегулиной
Поговорили с Ириной Жегулиной — клиническим генетиком, ведущим генетиком биомедицинского холдинга «Атлас».
Вы узнаете, как передаются наследственные заболевания, зачем консультироваться у генетика до рождения ребенка, можно ли рассчитать генетический риск любого заболевания и стоит ли сдавать популярные генетические тесты.
Что вы узнаете
- Всегда ли наследственные заболевания передаются из поколения в поколение?
- Всегда ли наследственные заболевания проявляются в детстве?
- Какие генетические заболевания самые распространенные?
- С какими проблемами обращаются к генетику?
- Что влияет на возникновение наследственных болезней у ребенка?
- Что делать парам с высоким риском передачи наследственных заболеваний детям?
- Всегда ли наличие плохого гена вызывает заболевание?
- В чем разница между наследственным заболеванием и наследственной предрасположенностью?
- Можно ли узнать заранее, заболеет человек с наследственной предрасположенностью или нет?
- Какие генетические анализы бесполезны?
- Стоит ли делать комплексные исследования генома вроде генетического паспорта?
- Можно ли определить спортивные способности или таланты человека с помощью генетического тестирования?
- Лечат ли наследственные заболевания?
Сходите к врачу
Наши статьи написаны с любовью к доказательной медицине. Мы ссылаемся на авторитетные источники и ходим за комментариями к докторам с хорошей репутацией. Но помните: ответственность за ваше здоровье лежит на вас и на лечащем враче. Мы не выписываем рецептов, мы даем рекомендации. Полагаться на нашу точку зрения или нет — решать вам.
Всегда ли наследственные заболевания передаются из поколения в поколение?
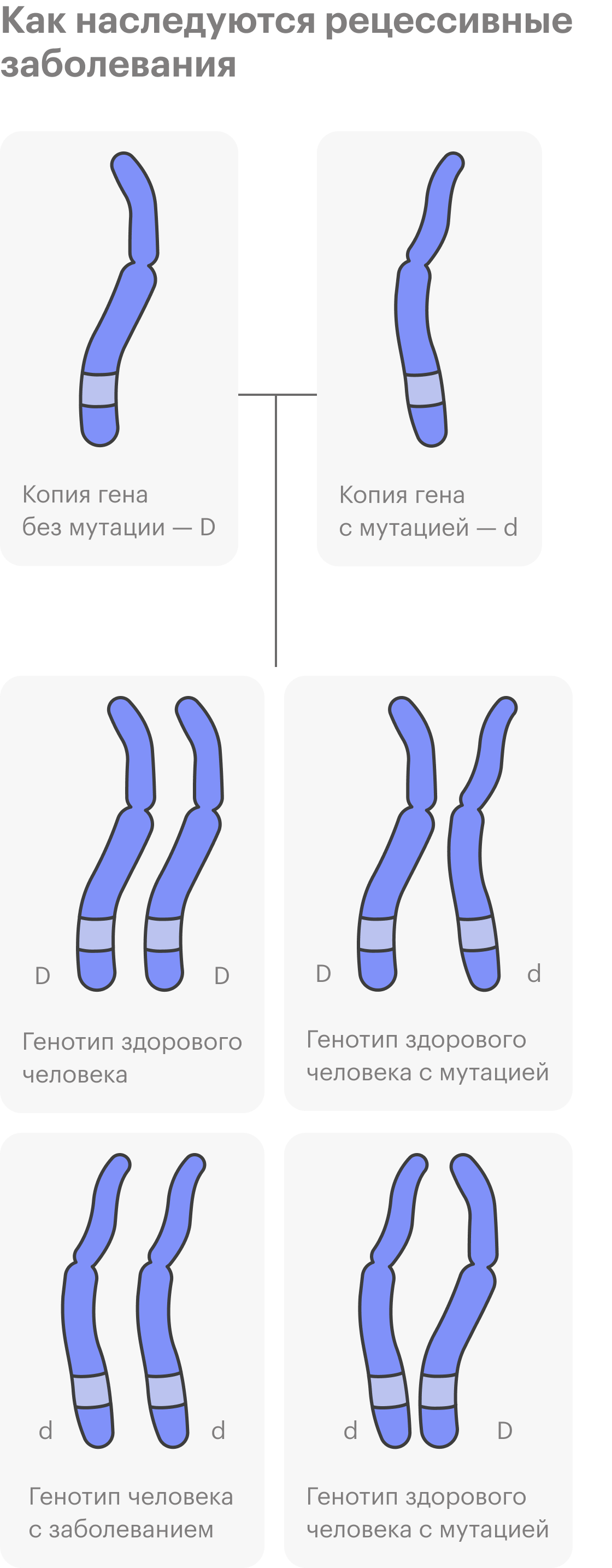
Довольно много наследственных заболеваний передаются в одной семье по наследству, и люди уже знают о своем риске. Однако далеко не всегда это так.
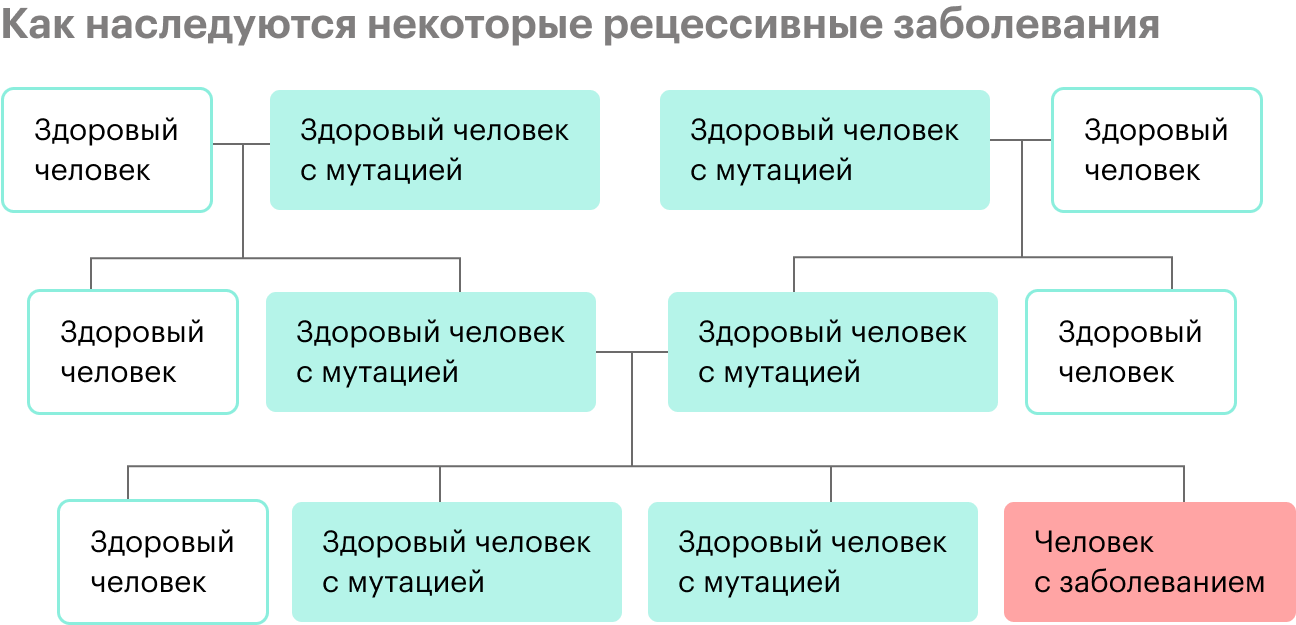
Бывают наследственные заболевания, которые не встречаются у других членов семьи, предков человека. Дело в том, что у здоровых людей могут быть рецессивные, то есть скрытые, мутации в геноме, и они никак не проявляются.
Потом два человека с одинаковой мутацией в ДНК или с разными мутациями, но в одном гене встречаются. В этом случае мутация может передаться ребенку, если он и от мамы, и от папы унаследует копии мутировавшего гена. К таким заболеваниям относят муковисцидоз, спинальную мышечную атрофию, наследственную глухоту и множество других, их более 6 тысяч.
Коварство таких состояний в том, что в семейной истории ни у кого никогда не было наследственной патологии — и вдруг неожиданно появляется ребенок с заболеванием.
Еще бывают генетические заболевания, которые относят к наследственным, но они не передаются по наследству, как бы странно это ни звучало. В этом случае возникают новые мутации — их называют мутациями de novo. Важно отметить, что будущим поколениям в 50% случаев болезнь уже передастся.
У родителей таких мутаций не было, они образовались на ранних этапах развития эмбриона или на этапе формирования половых клеток одного из родителей. Обычно такие заболевания доминантные: достаточно изменения одной копии гена, чтобы их вызвать. К ним относят ахондроплазию, то есть карликовость, или краниосиностоз, когда кости черепа у ребенка срастаются раньше, чем нужно.
Все перечисленные выше заболевания будут моногенными, то есть их развитие зависит от изменения одного гена.
Кроме того, есть хромосомные болезни — они также часто относятся к случайным геномным мутациям, только тут затрагиваются не отдельные гены, а целые хромосомы. Это, например, синдром Дауна.
При этом не все врожденные особенности и пороки развития будут связаны с генетикой, иногда они возникают и по другим причинам. Например, спина бифида — врожденный дефект позвоночника. Он может быть связан как с генными и хромосомными мутациями, так и с другими факторами, например недостатком фолиевой кислоты в рационе женщины.
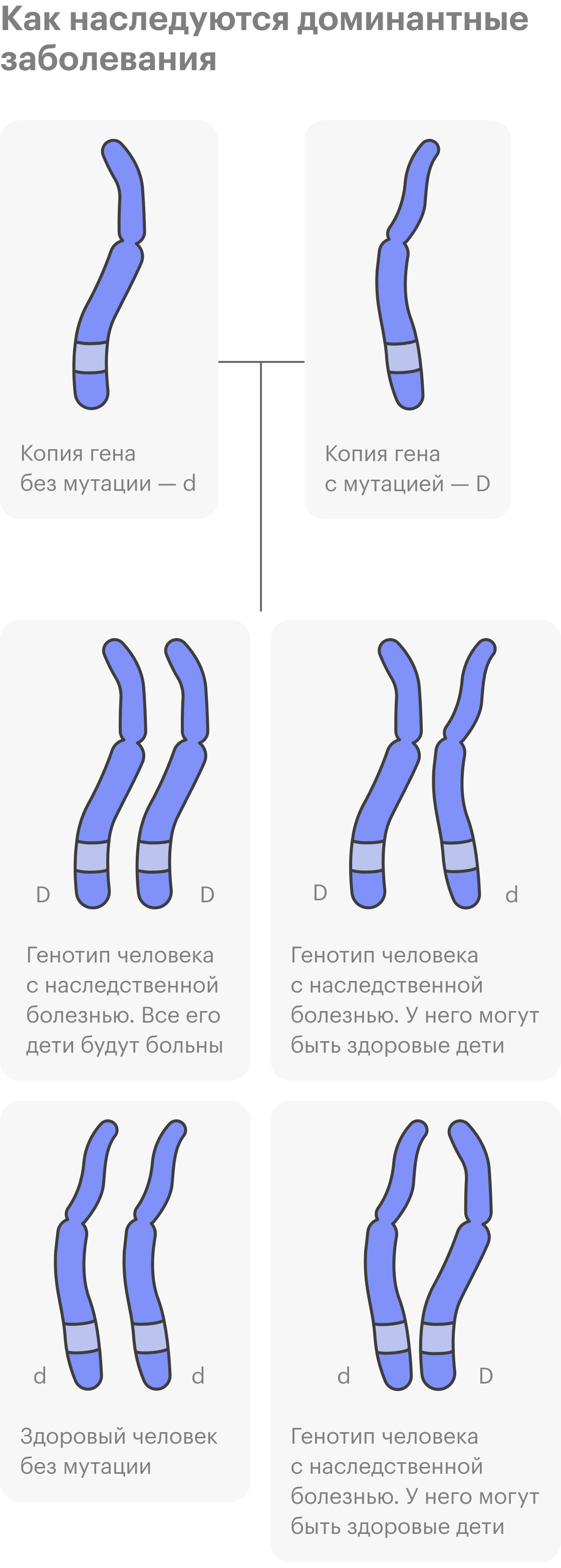
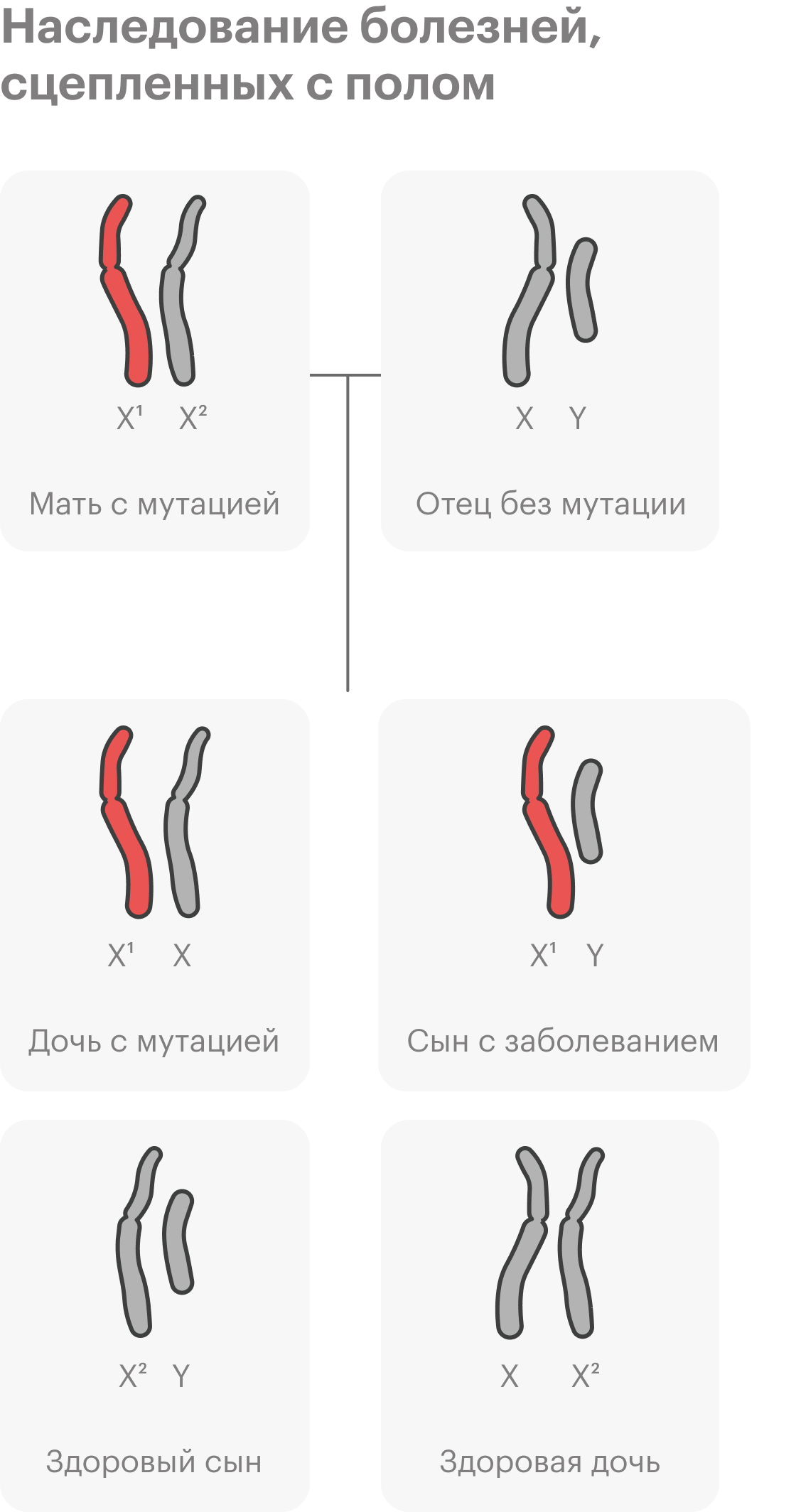
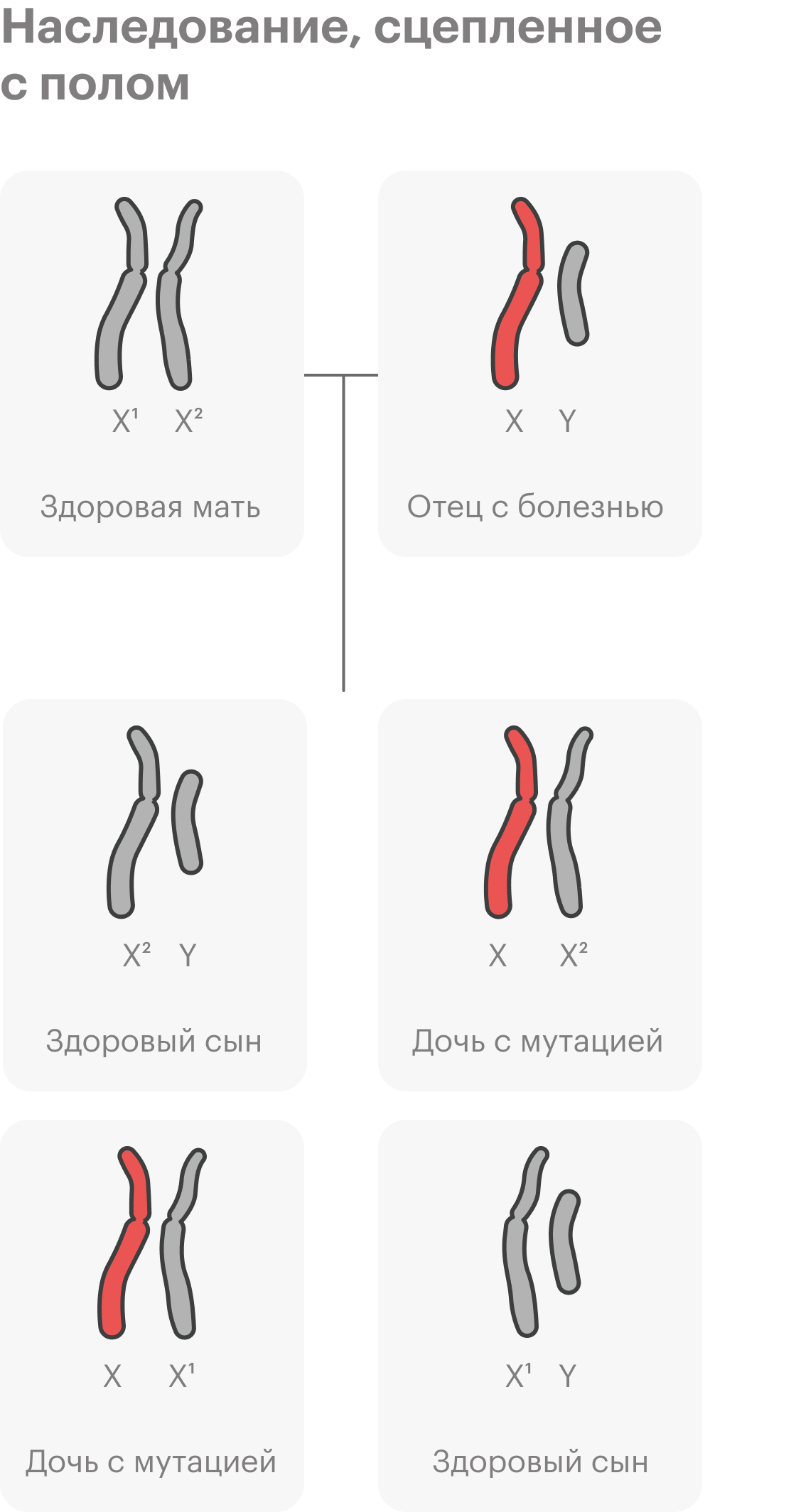
Всегда ли наследственные заболевания проявляются в детстве?
Чаще всего такие заболевания выявляют у детей. Однако есть болезни, проявления которых незаметны внешне, а симптомы могут появиться уже во взрослом возрасте.
Например, наследственные онкологические синдромы, наследственные нарушения ритма сердца, наследственные кардиомиопатии, то есть нарушения строения сердечной мышцы, синдром Альпорта — наследственное заболевание почек — и другие.
Такие состояния часто не диагностируют до взрослого возраста. Бывает, что люди узнают о них, когда заболевает кто-то из старшего поколения, начинается обследование и выясняется, что есть доминантная мутация, которая передается по наследству.
Какие генетические заболевания самые распространенные?
В разных популяциях разная частота наследственных болезней. Для европейской популяции, к которой относится большая часть России, одними из самых частых будут:
- муковисцидоз;
- спинальная мышечная атрофия, или СМА;
- фенилкетонурия;
- несиндромальная глухота;
- галактоземия;
- синдром Смита — Лемли — Опитца.
Есть наследственные заболевания, которые встречаются чуть реже. Однако, по сути, все они представляют большой континуум — нет такого, что одни самые частые и на них надо проверяться, а остальных почти не бывает.
Например, носителем муковисцидоза будет примерно каждый 30-й человек, спинальной мышечной атрофии — примерно каждый 40-й человек, глухоты — примерно каждый 25-й человек. Есть болезни с частотой носительства 1 на 45, 1 на 50 и так далее, потом она постепенно уменьшается.
Достаточно высокий шанс рождения ребенка с заболеванием, которое встречается с частотой больше чем 1 на 100. То есть для пары может быть рациональным заранее провериться на такие болезни.
Самый минимум для европейской популяции — провериться на носительство муковисцидоза и спинальной мышечной атрофии. Эти два заболевания входят в минимальные панели разных генетических лабораторий. Например, тестирование на четыре заболевания: муковисцидоз, СМА, фенилкетонурию и глухоту — стоит около 13 000 ₽ за одного человека. Результат будет через две недели.
Генетический скрининг можно расширить. Расширенный скрининг на максимальное количество мутаций будет стоить около 30 000 ₽ за человека. Делают такое исследование один-два месяца.


С какими проблемами обращаются к генетику?
Планирование семьи. К генетику могут обратиться люди, планирующие детей, чтобы провериться на носительство мутаций. Обычно за таким скринингом обращаются те, кто читал о наследственных патологиях или у кого есть знакомые семьи с детьми с наследственной болезнью.
Выявление патогенных мутаций. Первый вариант — когда в семье были заболевания, похожие на наследственные. Например, ранние случаи рака молочной железы или толстой кишки. В таких случаях люди хотят узнать, передалась ли им какая-то мутация.
Здесь обычно сначала обследуют члена семьи, у которого есть онкологический диагноз. Потом, если у него обнаружена патогенная мутация, на нее точечно проверяют близких родственников, которые могли унаследовать заболевание.
Другой вариант, когда здоровым людям могут быть показаны генетические скрининги, — это, например, обменные нарушения, в частности тест на особенности обмена холестерина.
Бывает, что он повышен уже в молодом возрасте из-за генетики, тогда даже молодым людям рекомендован прием специальных препаратов. Если не учитывать мутацию, можно пропустить своевременное начало терапии, которая позволяет сохранить здоровье и качество жизни.
Диагностика наследственных заболеваний. Здесь речь идет уже не о здоровых людях, а о ситуациях, когда есть подозрение на наследственное заболевание у ребенка или взрослого. Обычно люди обращаются к генетику по направлению другого специалиста: невролога, гинеколога, эндокринолога и других. В таких случаях проводят узкий анализ определенных генов, которые связаны с конкретным заболеванием.
Онкогенетика. Исследуют геном опухоли, чтобы подобрать таргетную терапию, максимально на нее влияющую, — иногда пациенты обращаются к онкогенетикам для помощи в расшифровке информации.
Еще бывает, что мутация в опухоли — не случайность, по косвенным признакам можно заподозрить ее наследственный характер. Тогда бывает, что обследуют здоровых родственников, чтобы как можно раньше подумать о снижении рисков и своевременных скринингах на рак.
Генетика в репродукции. При процедуре ЭКО часто проводят генетическое исследование эмбрионов — преимплантационное генетическое тестирование. Можно проверить эмбрион на хромосомные синдромы, тот же синдром Дауна, и на наследственные заболевания, если есть риск передачи мутаций от родителей. В таких случаях часто требуется консультация генетика, чтобы объяснить семье результаты тестирования.
Еще с помощью генетика семьи, которые планируют ЭКО, могут понять, хотят они исследовать эмбрионы, или отказаться от этого. Дело в том, что такие исследования сейчас не относят к диагностике, — это научные или скрининговые тесты.
Что влияет на возникновение наследственных болезней у ребенка?
Возраст матери. Он влияет в основном на риск хромосомных синдромов. Так, с 35 до 40 лет резко увеличивается вероятность родить ребенка с синдромом Дауна и более редкими синдромами Эдвардса и Патау.
Такие хромосомные синдромы — обычно следствие того, что в той клетке, которая в будущем станет яйцеклеткой, остаются лишние хромосомы.
В норме в процессе созревания половая клетка особым образом делится, и в ней должно быть по одной хромосоме из каждой пары. Однако в течение жизни в этом процессе накапливаются ошибки — в итоге хромосомы могут не разойтись, клетка поделится неправильно.
Частота рождения детей с синдромом Дауна в зависимости от возраста матери
| Возраст матери, лет | Число детей с синдромом Дауна |
|---|---|
| 15—29 | 1 на 1500 |
| 30—34 | 1 на 800 |
| 35—39 | 1 на 270 |
| 40—44 | 1 на 100 |
| После 45 | 1 на 50 |
Частота рождения детей с синдромом Дауна в зависимости от возраста матери
| Возраст матери, лет | Число детей с синдромом Дауна |
| 15—29 | 1 на 1500 |
| 30—34 | 1 на 800 |
| 35—39 | 1 на 270 |
| 40—44 | 1 на 100 |
| После 45 | 1 на 50 |
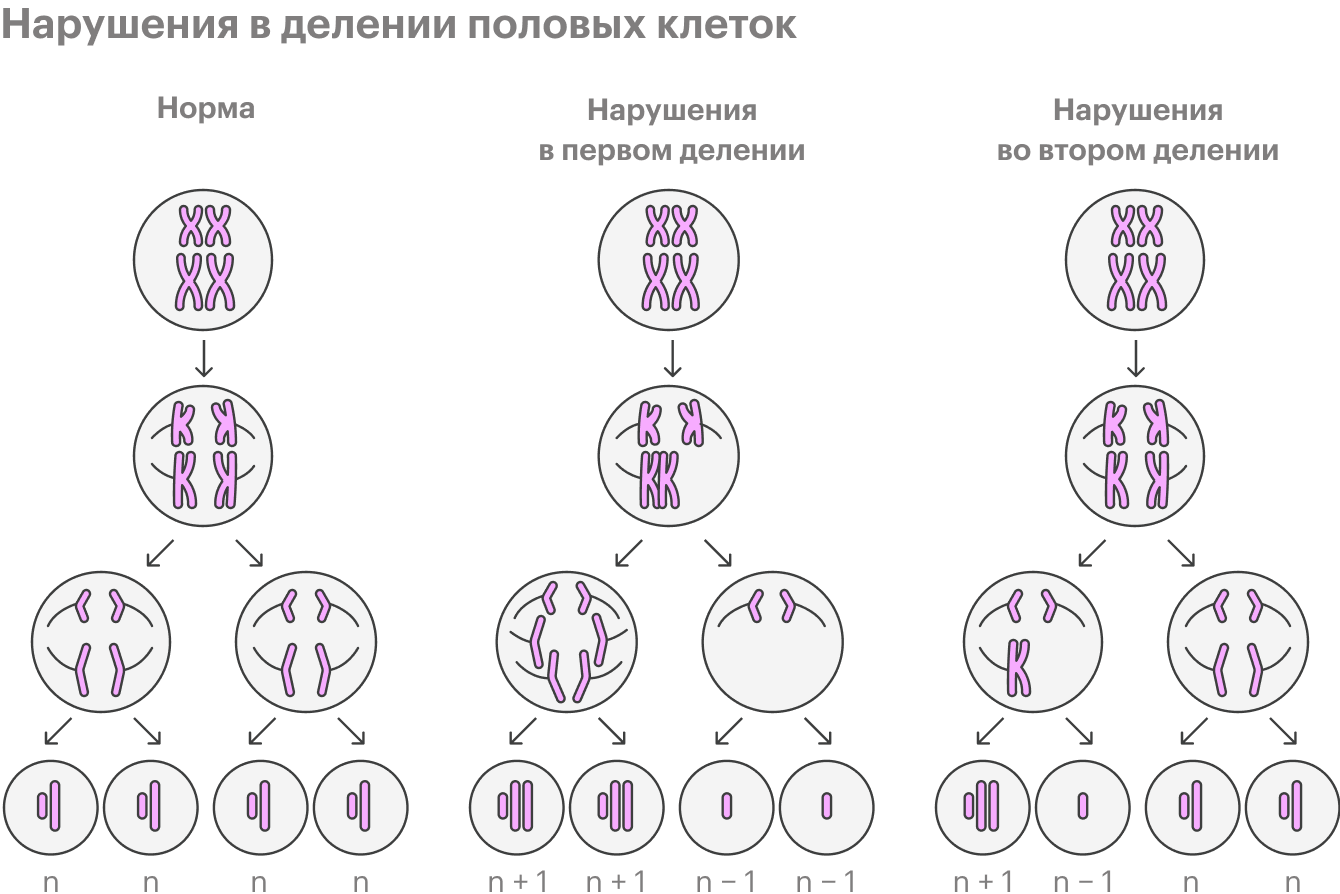
Возраст отца. От возраста отца зависит риск новых мутаций, то есть того, что у ребенка будет краниосиностоз, ахондроплазия и другие заболевания. После 45 лет у мужчины в сперматозоидах уже в 3—4 раза больше новых мутаций, чем в 25—30 лет.
Близкородственные браки. В этом случае повышается риск любых рецессивных заболеваний. Если у двух людей есть общий предок, выше шанс, что они унаследуют от него общие мутации. В таких случаях рекомендуют до зачатия сделать расширенное генетическое исследование, так как могут проявиться даже очень редкие мутации.
В изолированных популяциях, особенно там, где есть кровнородственные браки, например в Индии или Пакистане, чаще встречаются суперредкие, иногда даже не встречающиеся ранее наследственные заболевания.
Геннотоксичное воздействие на репродуктивные органы. Это облучение, например во время лечения рака, некоторые виды химиотерапии. Генетический материал при этом повреждается, а если потом восстанавливается, то с ошибками. Проверить наличие мутаций никак нельзя до наступления беременности.
В таких случаях молодым пациентам предлагают до начала терапии сохранить яйцеклетки или сперму, чтобы потом зачать ребенка без повышенных рисков.
Еще может влиять работа с радиацией или что-то подобное. Обычные вредные привычки плохо влияют на репродуктивную систему, способность к зачатию, развитие плода, но нельзя сказать, что они повышают риск наследственных заболеваний.
Что делать парам с высоким риском передачи наследственных заболеваний детям?
Вариантов много, это зависит от решения семьи, на которое могут повлиять культурные и религиозные воззрения. Задача врача — предоставить информацию о рисках и возможных последующих действиях.
Например, если известно, что риск высокий, а беременность уже наступила, можно провести инвазивную диагностику — биопсию ворсин хориона или амниоцентез, когда забирают несколько ворсин будущей плаценты или немного околоплодной жидкости и исследуют клетки плода. Это делают на сроке 11 и 16 недель соответственно.
При этих процедурах есть риск осложнений примерно 1% — это несопоставимо с риском рождения ребенка с наследственным заболеванием 25%. Далее семья может принять решение, продлевать беременность или ее прервать по медицинским показаниям.
Если пара с высоким риском только планирует беременность, она может сделать выбор в сторону ЭКО с исследованием эмбрионов, чтобы снизить риски. Кроме того, есть вариант с использованием донорских репродуктивных клеток — спермы или яйцеклеток, а также социальные варианты: усыновление или отказ от рождения детей.
Если у одного из партнеров есть наследственное заболевание, риск не всегда высокий. Например, если болезнь рецессивная, нужно проверить второго партнера на наличие аналогичных мутаций. Когда их нет, ребенок родится здоровым, его проверять не надо.
Всегда ли наличие «плохого» гена вызывает заболевание?
В генетике есть такие понятия:
- Пенетрантность — у скольких людей с такой мутацией проявляется заболевание.
- Экспрессивность — насколько сильно проявляются признаки заболевания.
С наследственными рецессивными заболеваниями все просто: повреждены обе копии гена, вариантов нормального функционирования белка, за который они отвечают, не остается.
С доминантными заболеваниями могут быть варианты. Например, если в геноме есть вторая копия гена без мутации, она может «сглаживать» действие доминантной копии с мутацией. В итоге болезнь может проявляться легче или не проявляться совсем.
Так происходит с геном BRCA 1 или 2 — он отвечает за риск рака молочной железы и яичников у женщин, но не 100% женщин с таким геном заболеют. Риск будет примерно 70% для рака молочной железы и 40% для рака яичников. То есть в отношении некоторых доминантных заболеваний можно смотреть статистику и ориентироваться на нее.
В чем разница между наследственным заболеванием и наследственной предрасположенностью?
Есть моногенные заболевания, когда развитие болезни в основном зависит от одного конкретного гена, про них мы говорили выше. А есть многофакторные, или полигенные заболевания — когда заболевание связано с изменениями во множестве генов, которые в совокупности повышают вероятность развития болезни. При этом обычно нужно еще воздействие внешних факторов, например образа жизни.
Приведу такой пример: атеросклероз — поражение сосудов холестериновыми бляшками. Он может быть обусловлен одной мутацией в гене рецепторов липопротеинов низкой плотности, так называемого плохого холестерина. В итоге они накапливаются в крови и у человека рано образуются холестериновые бляшки. Это моногенное состояние.
Еще развитие атеросклероза может быть связано со множеством генов — все вместе они повышают риск появления холестериновых бляшек в сосудах.
Можно ли заранее узнать, заболеет человек с наследственной предрасположенностью или нет?
Сейчас в генетике есть такое понятие, как расчет полигенных рисков. Существуют исследования, в которых сравнивали ДНК миллионов людей с разными заболеваниями. В итоге врачи знают, какие варианты генов связаны с некоторыми многофакторными болезнями.
Это знание можно перенести на конкретного человека: если мы видим в его геноме определенные варианты генов, то можем предупредить его о необходимости профилактики.
Существует список болезней, по которым есть достаточно достоверная информация и можно просчитать риски, особенно в сочетании с данными об анализах крови, образе жизни, питании, спортивной активности. Это, например, ишемическая болезнь сердца, инфаркт миокарда, сахарный диабет второго типа.
Дополнительно можно использовать машинное обучение и проверить данные исследований на выборке других людей, например из крупных европейских биобанков вроде UK Biobank, не участвующих в исследованиях. Это помогает точнее рассчитывать риски.
Конечно, пока просчитать риски на десять лет вперед можно не для всех заболеваний. Для многих требуются дальнейшие исследования.
Здесь еще надо учитывать этическую сторону. Не все стоит сообщать человеку — надо учитывать, может ли он что-то сделать с этим знанием.
Например, есть исследования о предрасположенностях к психиатрическим расстройствам, в том числе депрессии. Однако профилактики депрессии нет. Такое знание теоретически может только увеличить тревожность человека.
Общих стандартов в оценке полигенных рисков пока нет — это большой минус. У каждой компании, которая занимается таким анализом, есть свои правила, какие риски показывать клиентам, а какие нет.
Какие генетические анализы бесполезны?
Не стоит оценивать наследственные предрасположенности к болезням по анализу небольшого количества генов.
Например, когда в лаборатории предлагают оценить предрасположенность к гипертонии по трем мутациям, которые встречаются очень часто, в 40—50% случаев, у каждого второго. Это слишком часто, чтобы сильно влиять на здоровье.
Раньше были популярны генкандидатные исследования, когда у ученых была гипотеза, что изменения в каком-то гене влияют на риск заболевания. Они исследовали несколько точек на 100 людях и находили «статистически значимую» связь — это сейчас уже считается недостаточно достоверными данными.
При этом гипотеза выходит красивая, пациенту легко объяснить, что в этом гене нарушение, поэтому будет вот так. На самом деле сейчас в генетике используют до нескольких миллионов генетических вариантов, чтобы оценить точность прогноза.
В наше время есть много неправильных генетических исследований, но есть абсолютно научно обоснованные генетические тестирования — отличить одно от другого обычному человеку сложно.
По одному-двум генетическим полиморфизмам или мутациям можно проверить моногенные заболевания, еще есть отдельные признаки вроде непереносимости молочного сахара, которую оценивают по двум полиморфизмам. То есть так можно посмотреть простые признаки. А если говорить о многофакторных заболеваниях, то нужно смотреть много мутаций или генетических вариантов — связь показывают тысячи, миллионы из них.

Стоит ли делать комплексные исследования генома вроде «генетического паспорта»?
Здесь нельзя обобщить из-за того, что нет единых стандартов. Генетическим паспортом, или полным генетическим тестом, могут назвать все что угодно.
На месте человека, который собирается сделать комплексное генетическое исследование, я бы смотрела на три момента:
- Технические возможности компании — какие у нее мощности для обработки данных.
- Сколько в ней работает людей, в том числе биоинформатиков, генетиков и так далее. Стартап из трех человек не сможет качественно обработать массивы генетической информации, которые нужны для оценки рисков заболеваний, а также вовремя вносить обновления. Постоянно выходят новые публикации, проводят исследования, которые влияют на предыдущие данные. То есть должна быть возможность повторной интерпретации.
- Научные публикации, которые выпускает компания, — когда есть возможность работать с большими массивами данных, компания изобретает новые алгоритмы обработки и прочее, а потом о них рассказывает.
Правильно выполненные генетические тесты могут быть полезны. Например, в США есть проект Национального института здоровья, в рамках которого собирают геномы миллионов человек и информацию об их здоровье, чтобы дать им пользу и детальнее изучить ассоциации генов с разными заболеваниями и состояниями.
Если брать отдельные направления, например генетические тесты, направленные на персональные рекомендации по питанию, то такие делать не стоит: от генетики здесь зависит немного, нельзя подобрать рацион по ДНК.
Могут ли генетические исследования определить спортивные способности или таланты человека?
Исследования, на которых основаны такие тесты, изначально проводят на элитных спортсменах, в том числе олимпийских чемпионах. Например, сравнивают спортсменов силовых видов спорта с теми, кто преуспел в соревнованиях на выносливость. Контрольной группы из обычных людей нет — сравнивают две крайности. Кроме того, имеющиеся публикации не проходят по критериям качества: обнаруженные ассоциации спортивных качеств с генами очень слабые.
В 2016 году вышло рекомендательное письмо Австралийского института спорта о том, что генетические тесты на спортивные способности нарушают этические стандарты диагностики: родители делают такие тесты несовершеннолетним детям, потом выбирают им секции, а этих данных недостаточно, чтобы сделать подобный выбор. Некоторые компании прислушались и перестали предлагать подобные тесты, другие не прислушались.
То же самое с остальными талантами и склонностями: такие тесты опираются на слабые научные исследования. Их пробовали использовать как некую познавательную генетику. Однако люди воспринимают такие данные иначе: они начинают думать, что какой-то ген гарантирует талант, отправлять куда-то детей и так далее.
Лечат ли наследственные заболевания?
Существует более 6 тысяч разных наследственных заболеваний, они полностью не излечимы, но есть способы повлиять на их течение.
При нарушениях обмена веществ может быть назначена диетотерапия: исключают продукты, содержащие то, что человек усвоить не может. Так делают, например, при фенилкетонурии — это когда не усваивается аминокислота фенилаланин, промежуточные продукты ее обмена накапливаются, что сильно влияет на головной мозг, страдает интеллект.
Еще можно вводить внутривенно недостающие ферменты или другие вещества, чтобы организм нормально работал. Например, факторы свертывания при гемофилии, чтобы кровь сворачивалась. Конечно, не для всех заболеваний такие методы подходят.
Уже есть возможность редактирования генов — генная терапия. Например, когда нужный ген встраивают в отдельные органы или ткани, где потом начинают работать клетки с нужным участком ДНК.
Еще бывает генная терапия, которая направлена на исправление мутации, чтобы она не проявлялась. На этом основано лечение спинальной мышечной атрофии таким препаратом, как «Спинраза».
Редактировать геном на уровне эмбриона, чтобы человек родился уже здоровым, сложно и с технической, и с этической точки зрения. Такие методики используют на уровне исследований, но только тех эмбрионов, которые уже имеют грубые генетические дефекты и не разовьются в беременность.
В целом лечить наследственные заболевания сложно. Любая терапия лучше, чем ничего, иногда дает даже хороший эффект, но качество жизни людей с такими болезнями все равно ниже, чем у людей без них.
Кроме того, лечение не всегда доступно — часто оно слишком дорогое, какие-то современные препараты не зарегистрированы в России, какие-то не достать. Как генетик я считаю, что лучше провериться на этапе планирования семьи.
Запомнить
- Наследственные заболевания не всегда передаются из поколения в поколение: в семье может никто не болеть, а риск рождения ребенка с болезнью у пары существует.
- Наследственные заболевания могут проявляться во взрослом возрасте, хотя чаще всего их выявляют у детей.
- В разных популяциях разная частота встречаемости наследственных болезней — это нужно учитывать при скрининге на носительство патогенных мутаций.
- Проконсультироваться с генетиком стоит при планировании семьи, подозрении на наследственные заболевания, при некоторых онкологических болезнях.
- На возникновение наследственных заболеваний может влиять возраст родителей, лечение онкозаболеваний, близкородственные браки, работа с радиацией.
- Парам с высоким риском передачи наследственных заболеваний можно подумать об альтернативных вариантах рождения детей, например ЭКО с проверкой эмбрионов.
- Наличие мутаций не всегда связано с развитием заболеваний, они могут проявляться не у всех и по-разному.
- Предрасположенность к заболеванию означает, что у человека есть риск заболеть, связанный со многими генами, также он зависит от влияния факторов среды.
- Не для всех многофакторных болезней можно рассчитать риски, но для некоторых это уже реально.
- Не стоит сдавать анализы на предрасположенность к болезням, которые основаны на одном или нескольких генах.
- Комплексный анализ генома может быть полезен, но его лучше делать в компании, у которой есть возможность анализировать огромные массивы данных.
- Генетические тесты не помогут оценить спортивные склонности и творческие способности.
- Наследственные заболевания не лечатся, но есть способы повлиять на их течение.